- · 《肿瘤学杂志》期刊栏目[01/26]
- · 《肿瘤学杂志》投稿方式[01/26]
- · 肿瘤学杂志版面费是多少[01/26]
柳叶刀-肿瘤学|晚期HER2阳性乳腺癌治疗小分子靶
作者:网站采编关键词:
摘要:《柳叶刀-肿瘤学》(The Lancet Oncology)近日在线发表由中国医学科学院肿瘤医院徐兵河教授牵头的一项多中心、开放标签、随机III期临床试验,旨在评估吡咯替尼联合卡培他滨对比拉帕
《柳叶刀-肿瘤学》(The Lancet Oncology)近日在线发表由中国医学科学院肿瘤医院徐兵河教授牵头的一项多中心、开放标签、随机III期临床试验,旨在评估吡咯替尼联合卡培他滨对比拉帕替尼联合卡培他滨治疗晚期HER2阳性乳腺癌的抗肿瘤活性和安全性。研究结果显示,吡咯替尼方案相较拉帕替尼方案显著延长晚期二线患者的中位PFS(无进展生存期,progression-free survival)(12.5个月vs 6.8个月),这一数据在目前晚期乳腺癌二线治疗领域尚未有其他研究超越。尤其对于曲妥珠单抗耐药的患者,吡咯替尼同样可以显著延长患者PFS(12.5个月vs 6.9个月)。我们邀请作者团队对文章进行解读。
作者介绍
徐兵河
教授,主任医师,博士生、博士后导师。中国医学科学院、北京协和医学院学术委员会委员,国家肿瘤质控中心乳腺癌专家委员会主任委员。
文章解读
人表皮生长因子受体2(HER2)被公认为是HER2阳性乳腺癌药物治疗的靶点,大约15%到20%的乳腺癌患者会发生HER2基因改变[1]。对于转移性患者,标准的一线治疗是曲妥珠单抗+帕妥珠单抗+紫杉醇[2,3],但由于活性靶受体或下游PI3K/Akt/mTOR信号通路的改变,曲妥珠单抗耐药难以避免。目前迫切需要开发更多的抗HER2药物来治疗曲妥珠单抗和/或帕妥珠单抗治疗失败的患者。
吡咯替尼是第二代、不可逆的、吸收良好的泛ErbB受体酪氨酸激酶抑制剂,靶向EGFR、HER2和HER4[4]。1期试验初步证实了在既往经过多线治疗的HER2阳性转移性乳腺癌中,吡咯替尼单药及联合卡培他滨的安全性和疗效。在开放标签,多中心,随机II期研究中,纳入了既往接受过紫杉类,蒽环类和/或曲妥珠单抗治疗的患者。
与拉帕替尼联合卡培他滨治疗相比,吡咯替尼联合卡培他滨显著提高了客观缓解率(78.5%比57.1%)和无进展生存期(研究者评估的风险比,0.36[95%CI,])[5,6]。基于这些发现,吡咯替尼联合卡培他滨在中国获得批准,条件是承诺进行验证性第三阶段研究[7]。在此背景下,我们进行了PHOEBE III期研究,以进一步验证吡咯替尼联合卡培他滨对比拉帕替尼+卡培他滨治疗HER2阳性转移性乳腺癌患者的疗效和安全性。
研究方法
PHOEBE是一项在中国29个中心进行的多中心、开放标签、随机对照的III期试验。纳入标准为经病理证实为HER2阳性转移性乳腺癌,既往接受过曲妥珠单抗和紫杉类治疗,允许接受过蒽环类治疗。其他关键的纳入标准包括:年龄18-70岁,转移性疾病阶段至多接受过2线化疗,根据实体肿瘤反应评估标准(RECIST)1.1版,至少存在一个可测量病灶,东部肿瘤协作组(ECOG)健康状况评分为0或1,预期寿命至少12周。
基于中央交互式网络响应系统,患者被随机分配(1:1)接受吡咯替尼(400mg/d)或拉帕替尼(1250mg/d)治疗,均联合卡培他滨(1000mg/m2,每日两次,第1-14天/每21天为一周期)。主要终点为无进展生存期(PFS),定义为自随机化至首次记录为影像学进展(BICR评估)或任何原因死亡的时间。次要终点包括研究者评估的PFS,BICR及研究者总生存期(OS,自随机化后至任何原因死亡的时间),客观缓解率(ORR,最佳客观缓解达完全或部分缓解的患者比例),至进展时间(TTP,自随机化至首次记录疾病进展的时间),缓解持续时间(DoR,自首次完全或部分缓解至进展或死亡的时间),临床获益率(最佳客观缓解达完全或部分缓解及疾病稳定,且维持≥24周的患者比例)及安全性。
研究结果
2017年7月31日至2018年10月30日,试验共纳入266例患者,134例随机接受吡咯替尼联合卡培他滨治疗(吡咯替尼组),132例接受拉帕替尼联合卡培他滨治疗(拉帕替尼组)。拉帕替尼组有1例患者没有接受研究药物,因此被排除在全分析集和安全性分析集之外。两组之间的基线特征总体平衡。(Figure 1)
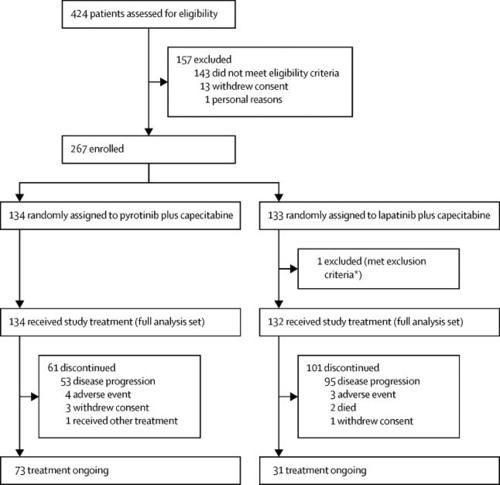
Figure 1:Trial profile
*One patient in the lapatinib group was found to have bipolar disorder (exclusion criterion) after randomisation and before study drug administration.
在中期分析数据截止时(2019年3月31日),吡咯替尼组和拉帕替尼组的中位随访时间分别为10.5个月(95%CI,9.3-11.1)和9.7个月(95%CI,8.6-11.0)。与拉帕替尼联合卡培他滨相比,吡咯替尼联合卡培他滨显著提高了BICR评估的PFS(中位12.5个月[95%CI,9.7-未达到]对比6.8个月[95%CI,5.4-8.1](Figure 2(A));疾病进展或死亡的风险比,0.39[95%CI,];单侧p
文章来源:《肿瘤学杂志》 网址: http://www.zlxzzzz.cn/zonghexinwen/2021/0304/388.html